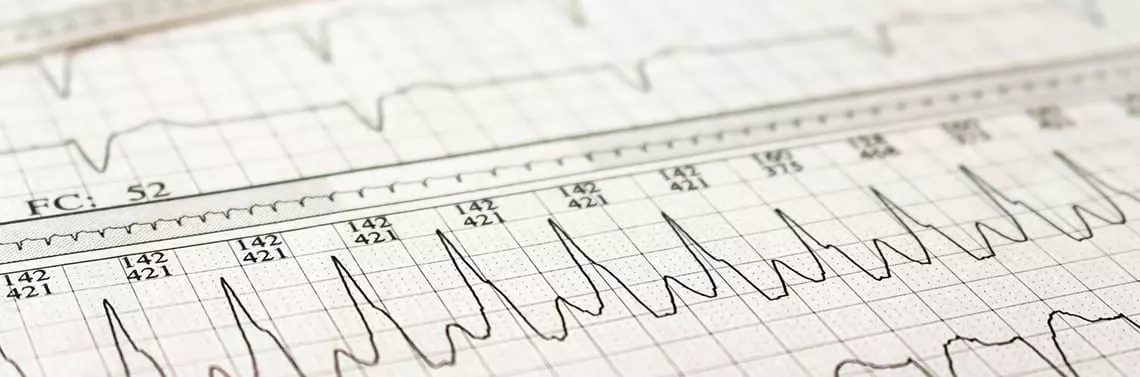
Migotanie przedsionków (AF) jest jedną z najczęściej występujących arytmii, a częstość występowania w populacji ogólnej wynosi 1–4%. Wraz ze starzeniem się społeczeństwa spodziewany jest 2–3-krotny wzrost liczby zachorowań w ciągu najbliższych lat. Wśród najważniejszych czynników ryzyka wystąpienia AF wymienia się starszy wiek, płeć męską, czynniki genetyczne, a także czynniki kliniczne, w tym choroby, takie jak: nadciśnienie tętnicze, niewydolność serca, przewlekłą obturacyjną chorobę płuc, otyłość, obturacyjny bezdech senny oraz inne. Szacuje się, że ryzyko zgonu u chorych z AF jest prawie dwukrotnie wyższe niż w populacji ogólnej bez AF [1], a ryzyko wystąpienia udaru niedokrwiennego mózgu jest w tej grupie aż pięciokrotnie wyższe. Co więcej, udar mózgu w przebiegu AF wiąże się z większą śmiertelnością oraz gorszymi wynikami leczenia [2, 3]. Zatem identyfikacja pacjentów z AF, prowadzenie badań przesiewowych oraz interdyscyplinarna współpraca lekarzy specjalistów, lekarzy pierwszego kontaktu, a także samych chorych, powinna znajdować się na liście priorytetów współczesnej medycyny.
W 2020 roku ukazały się nowe wytyczne Europejskiego Towarzystwa Kardiologicznego (ESC), przetłumaczone na język polski przez Polskie Towarzystwo Kardiologiczne (PTK), które zmieniają nieco spojrzenie na leczenie chorych z AF.
POLECAMY
AF a niewydolność serca
Wytyczne z 2020 roku poświęcają więcej uwagi chorym z AF i zastoinową niewydolnością serca (CHF). Częstość występowania AF rośnie wraz ze wzrostem zaawansowania CHF według skali New York Heart Association (NYHA), w klasie IV NYHA już co drugi pacjent będzie obciążony migotaniem przedsionków. Migotanie przedsionków de novo u chorych z CHF wiąże się z 1,6–2,7-krotnym ryzykiem zgonu, a u chorych, u których CHF rozwinie się na podłożu AF, ryzyko to wzrasta 2,7–3,1-krotnie [4]. Schorzenia te wzajemnie pogarszają swoje rokowanie, a CHF dodatkowo zwiększa ryzyko zakrzepowo-zatorowe u chorych z migotaniem przedsionków.
Leczenie – zintegrowana ścieżka ABC
Chorzy z AF to bardzo heterogenna grupa, a ich zindywidualizowane leczenie powinno zależeć od manifestacji objawów oraz chorób towarzyszących. Podczas gdy kliniczny obraz AF może zawierać się w braku jakichkolwiek objawów AF, aż do ciężkiej niepełnosprawności, badania zgodnie pokazują, że większość chorych z AF ma pogorszoną jakość życia. Pomocą w ocenie nasilenia dolegliwości jest skala European Heart Rhythm Association (EHRA), która ułatwić może podejmowanie decyzji terapeutycz...